ギラン・バレー症候群(Guillain‐Barré syndrome、GBS) は、急速に発症する四肢筋力低下と腱反射消失を主徴とする自己免疫性末梢神経疾患で、本邦の発症頻度は人口10 万人当たり年間1.15人と推定されています。GBSの診断は、AsburyとCornblathの診断基準が頻用されており、二肢以上における進行性の脱力と腱反射低下等の臨床症状、発症4週以内に症状がピークとなることや、髄液・神経伝導検査等の結果により総合的に診断されます。しかし、経過を通じて腱反射が保たれることがあり、注意を要します。また、脱力が4週以上経過しても進行する場合は、他の疾患を疑います。
GBSの血清中に各種ガングリオシドと反応する自己抗体が検出されることが明らかにされています。特にIgG抗GM1抗体はGBSの約半数に検出され、最もよく検査されています。抗ガングリオシド抗体は、健常者や他の神経疾患で検出されることはまれで、検出されても低力価です。また、発症早期から血清中に検出されるため、病初期におけるGBSの補助診断マーカーとして有用です。
血清中IgG抗GM1抗体の検出はGBSの鑑別診断に有用であり、GBSが疑われた時点で本検査を行うことで早期治療の開始、早期回復、後遺症の軽減が期待できます。
ELISA法を用います。
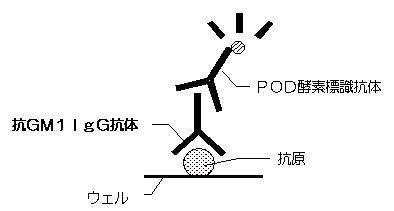
本法は、2ステップサンドイッチ法を利用した酵素免疫測定法(ELISA, enzyme‐linked immunosorbent assay)により、血清中のIgG抗GM1抗体を検出します。
ガングリオシドGM1を固相化させた抗原固相化プレートのウエルに検体中の抗GM1抗体を反応させ、洗浄後ぺルオキシダーゼ標識ウサギ抗ヒトIgGポリクローナル抗体を加えて反応させると、検体中のIgG抗GM1抗体を介した3者のサンドイッチ複合体が形成されます。
未反応のぺルオキシダーゼ標識ウサギ抗ヒトIGgポリクローナル抗体を洗浄により除去後、発色基質を加えて酵素反応を行います。
固相に結合した血清中のIgG抗GM1抗体は、ぺルオキシダーゼと発色基質との反応に伴う発色量に反映されるため、これを測定することによりIgG抗GM1抗体の検出を行うことができます。
フィッシャー症候群(Fisher syndrome, FS) は、外眼筋麻痺、運動失調、腱反射の低下ないし消失を主徴とする疾患です。多くは呼吸器系(上気道炎等) あるいは消化器系(胃腸炎等)等の先行感染症状に引き続いて発症し、単相性の経過をとり、髄液検査において蛋白細胞解離がみられる等の特徴があります。ギラン・バレー症候群(Guillain‐Barré syndrome, GBS) と共通する特徴を有することから、同症候群の亜型と考えられています。FS は、外眼筋麻痺や運動失調等の臨床症状、発症4週以内に症状がピークとなることや、髄液検査等の結果より総合的に診断されます。
FSではGBSと同様にガングリオシドと反応する自己抗体が産生され、7~9 割の患者血清中にIgG抗GQ1b 抗体が検出されることが報告されています。抗ガングリオシド抗体は、健常者や他の神経疾患で検出されることはまれで、検出されても低力価です。IgG 抗GQ1b抗体は本症例に特異性が高く、また発症早期から血清中に検出されるため、診断マーカーとして非常に有用です。
血清中IgG抗GG1b抗体の検出はFSの鑑別診断に有用であり、FSが疑われた時点で本検査を行うことで早期治療の開始、早期回復、後遺症の軽減が期待できます。
ELISA法を用います。
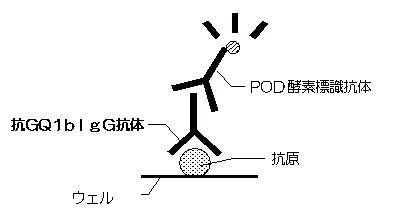
本法は、2ステップサンドイッチ法を利用した酵素免疫測定法(ELISA, enzyme‐linked immunosorbent assay) により、血清中のIgG抗GQ1b抗体を検出します。
ガングリオシドGQ1bを固相化させた抗原固相化プレートのウエルに検体中の抗GQ1b抗体を反応させ、洗浄後ぺルオキシダーゼ標識ウサギ抗ヒトIgGポリクローナル抗体を加えて反応させると、検体中のIgG 抗GQ1b抗体を介した3者のサンドイッチ複合体が形成されます。
未反応のぺルオキシダーゼ標識ウサギ抗ヒトIgGポリクローナル抗体を洗浄により除去後、発色基質を加えて酵素反応を行います。固相に結合した血清中のIgG抗GQ1b抗体は、ぺルオキシダーゼと発色基質との反応に伴う発色量に反映されるため、これを測定することによりIgG抗GQ1b抗体の検出を行うことができます。
夏型過敏性肺炎は、我が国の過敏性肺炎の75%を占め、かつ近年増加している重要なアレルギー性疾患ですが、その原因真菌としてトリコスポロン・アサヒ(Trichosporon asahii )が最も重要と報告されています。抗トリコスポロン・アサヒ抗体の検出は、原因抗原がトリコスポロン・アサヒであることを示す、夏型過敏性肺炎の診断に有用な検査法です。
本検査では、類似菌種であるクリプトコッカス・ネオフォルマンス(Cryptococcus neoformans )やトリコスポロン・ムコイデス(Trichosporon mucoides )に対する交叉反応を抑え、抗トリコスポロン・アサヒ抗体への特異性を高めています。
Antigen-captured ELISA法を用います。
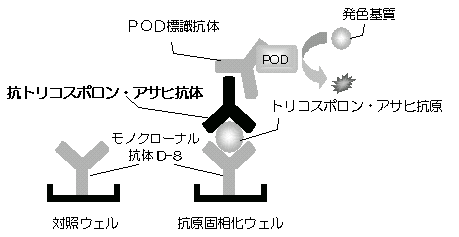
本法は、Antigen-captured ELISA法(ELISA;enzyme-linked immunosorbent assay)により、血清中の抗トリコスポロン・アサヒ抗体を検出します。
マイクロプレートに抗トリコスポロン・アサヒ-モノクローナル抗体D-8のみを結合させたウェル(対照ウェル)と、D-8を介してトリコスポロン・アサヒ抗原を結合させたウェル(抗原固相化ウェル)、各1ウェルを一組として操作します。
検体中の抗トリコスポロン・アサヒ抗体をトリコスポロン・アサヒ抗原と反応させ、ペルオキシダーゼ標識抗ヒトIgGポリクローナル抗体(POD標識抗体)を加えて反応させると、検体中の抗トリコスポロン・アサヒ抗体を介したサンドイッチ複合体が形成されます。未反応のPOD標識抗体を洗浄により除去後、発色基質を加えて酵素反応を行います。
抗原に結合した検体中の抗トリコスポロン・アサヒ抗体は、ペルオキシダーゼと発色基質との反応に伴う発色量に反映されるため、これを測定することにより抗トリコスポロン・アサヒ抗体の検出を行います。
本法では、検体と同時に測定する陽性コントロールを基準に各検体の補正吸光度(Corrected Absorbance Index、CAI)を算出し、CAIより判定を行います。
ペリオスチン(Periostin) :別名Osteoblast-specific factor 2 (OSF-2)は、ファシクリンファミリーに属する分子量約9万の細胞外マトリックスタンパク質です。 その構造は、末端からシステイン残基に富むEMIドメインに始まり、4つのfasciclin I (FAS1)ドメインがその後に続きます。 EMIドメインには、Ⅰ型コラーゲンやフィブロネクチンが、FAS1ドメインには、テネイシンCが結合することが報告されています。
ペリオスチンはTh2型サイトカインであるIL-4/IL-13によってその発現が誘導されます。 このことからTh2型アレルギー状態の指標となります。 さらに種々の線維化を伴う疾患でも発現が上昇していることが明らかにされました。
個々の疾患では、アトピー性皮膚炎、気管支喘息、全身性強皮症、胆管細胞癌、糖尿病性網膜症などで血中ペリオスチン濃度が上昇することが報告されています。 さらに近年、ペリオスチンは、喘息患者に対する分子標的薬の治療効果予測因子として注目されています。
本検査では、類似蛋白質であるβig-h3には反応しません。
ELISA法を用います。
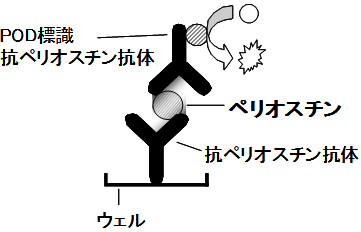
本法は、サンドイッチ法を利用した酵素免疫測定法(ELISA;enzyme-linked immunosorbent assay)によるペリオスチン定量測定試薬です。
抗ペリオスチンモノクローナル抗体を結合させた固相ウェルに検体を加え、検体中のペリオスチンを抗体と特異的に結合させます。
次に標識した抗ペリオスチンモノクローナル抗体を加え、抗原抗体複合体を形成させます。 この複合体に発色剤を加えて発色させます。
発色停止後、450 nmの吸光度を測定します。
SCCA(squamous cell carcinoma antigen)は、serpin スーパーファミリーに属するセリンプロテアー ゼインヒビターであり、主に上皮細胞から産生される分子量約45 kDa のタンパク質です。
SCCA にはSCCA1(SERPIN B3)とSCCA2(SERPIN B4)というアイソフォームが存在し、アミノ 酸レベルでの相同性は91%と非常に高いものの、異なる遺伝子座から転写される独立した遺伝子産物です。
アレルギー性炎症の中心はTh2 型免疫反応であり、Th2 型サイトカインの一つであるインターロイキン13 (IL-13)が重要な役割を果たしていることが知られています。SCCA2 は、アレルギー反応において中心的に 働くサイトカインであるIL-4 及びIL-13 で気道上皮細胞を刺激した際に発現が上昇する分子の一つとして同 定されました。
小児アトピー性皮膚炎患者における血清SCCA2 値は、既存の血液検査に比べても有意にその重症度に応じて 上昇していることが報告されています。 アトピー性皮膚炎の治療においては、その重症度に応じて抗炎症薬を適 切に選択・使用することが重要です。 血清SCCA2 は、小児アトピー性皮膚炎の重症度の指標として有用なマ ーカーとなり得ることが示唆されました。
ELISA法を用います。
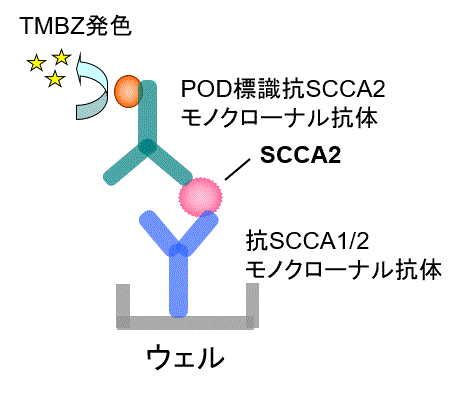
本法は、酵素免疫測定法(ELISA:enzyme-linkedimmunosorbent assay)により、血清中のSCCA2 を 測定します。
抗SCCA 抗体を固相化させた96穴マイクロプレートウェル(固相)に検体中のSCCA2 を反応させ、洗浄後、 POD 標識抗SCCA2 抗体を加えて反応させると、検体中の SCCA2 を介した免疫複合体が形成されます。
未反応のPOD 標識抗SCCA2 抗体を洗浄により除去後、発色基質を加えて酵素反応を行います。
固相の抗体に結合した検体中のSCCA2 濃度は、POD と発色基質との反応に伴う発色量に反映されるため、 これを測定することによりSCCA2 濃度を求めます。
血液凝固制御因子であるプロテインSの異常/欠乏は、静脈血栓塞栓症(venous thromboembolism, VTE)の危険因子であり、日本人の血栓性素因であることが明らかになりました。日本人には「プロテインS徳島」というプロテインSの機能低下を伴う遺伝子変異が1.3%~1.8% に存在し、その保因者はVTEを発症する危険性が高くなります(Odds比:3.7~8.6)。これまで、「プロテインS徳島」などのプロテインS機能異常を正確に診断するには、遺伝子検査に頼らざるを得ず、時間と手間が掛かり煩雑でした。
プロテインS比活性検査は、自動分析装置で総プロテインS活性と蛋白量を測定し、蛋白量あたりの活性(総活性 / 総蛋白量)を算出してプロテインS機能低下を判定します。したがって、プロテインS比活性検査は、これまでより迅速かつ簡便にプロテインS機能異常を検出することができるので、VTEの予防や診断・治療に大いに役立つものと思われます。
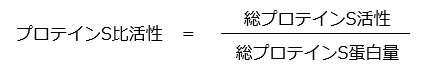
総プロテインS蛋白量に対する総活性の比率をプロテインS比活性としました。
ラテックス凝集比濁法
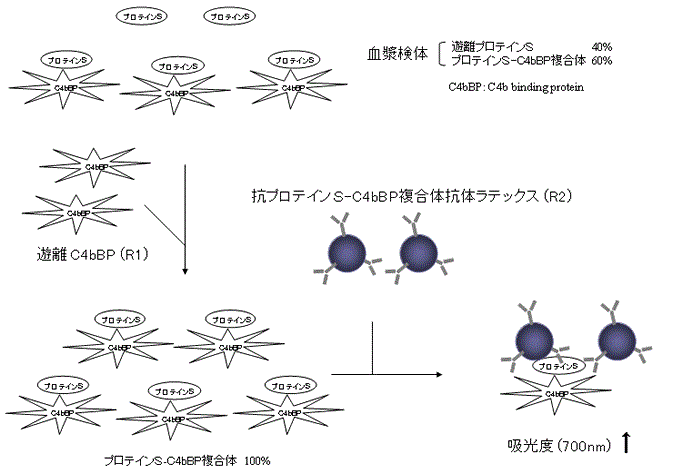
プロテインS は、生体中ではC4b binding protein (C4bBP)と結合したC4bBP-プロテインS 複合体(複合体型プロテインS)と遊離プロテインS が存在しています。
第一反応で検体中の遊離プロテインS にC4bBP を結合させ、全てのプロテインS を複合体型プロテインS にします。第二反応で複合体型プロテインS は、抗ヒトプロテインS マウスモノクローナル抗体感作ラテックスと反応し、凝集を生じます。この凝集を吸光度変化(濁度変化量)としてとらえることにより、検体中の総プロテインS 抗原(蛋白量)を測定します。
比色法
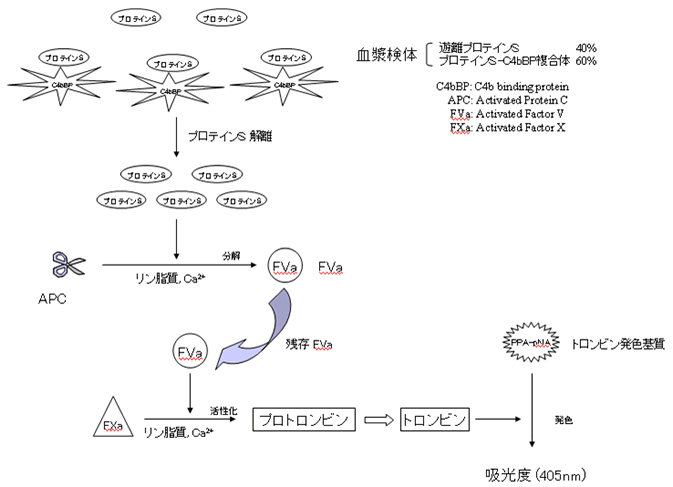
第一反応で検体(プロテインS)、活性化プロテインC および活性化第Ⅴ因子(FVa)を反応させFVaを分解します。第二反応は、第一反応での残存FVa、活性化第Ⅹ因、プロトロンビンおよびトロンビンの発色合成基質(D-フェニルアラニル-L-ピペコリル-L-アルギニル-p-ニトロアニリド・塩酸塩、PPA-pNA)を反応させ、生成するトロンビンによりトロンビン基質を発色させます。
第一反応での残存FVaは、総プロテインS活性に依存するため、PPA-pNAの発色は総プロテインS活性を反映します。したがって、PPA-pNAの発色による吸光度変化をとらえることにより、検体中の総プロテインS 活性を測定します。
亜鉛は生体内に広く分布する必須微量金属の一つであり、多くの金属酵素の重要な構成成分として存在します。
そのため、亜鉛欠乏の検出は疾患の治療に結びつく重要な情報の一つとなります。
亜鉛欠乏は、摂取量の低下、慢性的な下痢などによる吸収阻害、亜鉛にキレート能をもつ薬剤の投与、高度の発汗、
肝障害などによる低分子リガンド増加などで起こり、その症状としては、味覚・臭覚障害、食欲低下、皮膚炎、
創傷治癒遅延などが知られています。
また近年、低亜鉛母乳による乳児の亜鉛欠乏症が報告されています。
母体の血中亜鉛値は正常でありながら、母乳中亜鉛値が低値を示すことがあります。
生後2~3ヶ月の乳児で発症することが多いと言われています。
乳児への亜鉛補充は奏効を示しますが、母親への亜鉛補充では母乳中亜鉛値の上昇が認められないとの報告があります。
直接法( 5-Br -PAPS )を用います。
本法は、直接法( 5-Br -PAPS )により、検体中の亜鉛を定量します。
検体中の亜鉛(Zn2+)は、アルブミン、α2 -マクログロブリンに主に結合しています。
Zn2+は、2-(5-ブロモ-2-ピリジルアゾ)-5-(N-プロピル-N-スルホプロピルアミノ)フェノールナトリウム(5-Br -PAPS)とキレート化合物を作り発色します。
この色素を比色して検体中の亜鉛値を求めます。

サイトメガロウイルス(CMV)は、主に幼少期に不顕性感染の形で感染し、その後は生涯にわたり潜伏感染しています。
しかし、胎児のうちにCMV感染を起こしてしまうと、低出生体重・肝機能異常・小頭症のほか多様な症状を呈し、高率に神経学的後遺症を残すとされています。
また、出生時は無症候性であっても、遅発性に難聴などの症状を発することが有ります。
PCR法( リアルタイムPCR )を用います。
新生児のろ紙尿中に含まれるCMV-DNAをPCR法にて増幅させます。
本検査は研究目的であり、診断には使用できません。
陽性になった場合は、すぐに確定検査を実施いただく必要がございます。
確定検査は、出生後3週間以内の液体尿で検査を行う必要があります。
これは、尿中のウイルス量が血中の100~1000倍多く存在し、また、出生後の後天的な感染ではウイルスが尿に出現するまで3週間程度を要するためです。